Исследования и разработки компании Johnson & Johnson
отражает наш особый подход к инновациям.

Мы работаем в сфере здравоохранения уже 60 лет. Мы проводим научные исследования и улучшаем жизнь людей. Мы разрабатываем инновационные лекарственные средства и концепции лечени�я. Однако с момента изобретения нового лекарства до начала применения препарата пациентом проходит много времени.
В рамках наших доклинических испытаний мы проделываем путь от выбора перспективной субстанции до создания препарата. Инновационные центры по всему миру предоставляют нам доступ к самым современным технологиям и новейшим научным данным.
В клинических испытаниях — научных исследованиях с участием людей, проводится оценка эффективности и безопасности лекарственного препарата.

От молекулы до лекарственного препарата
Как создается новый лекарственный препарат? Для создания нового лекарственного препарата нужны научные испытания, современные разработки и, конечно, вовлеченные в процесс компетентные специалисты. Весь процесс разработки нового лекарства обычно занимает более десяти лет, a его стоимость составляет не менее 1–2 млрд долларов.
Как создается новый лекарственный препарат?

Процесс создания нового лекарственного препарата обычно занимает более десяти лет, а его стоимость составляет не менее 1–2 млрд долларов США.
Сначала необходимо найти вещество, которое, вероятно, можно будет применять для лечения заболевания или облегчения его течения. Это может быть химическое соединение, экстракт растительного или животного происхождения, биопрепарат, полученный благодаря использованию биотехнологий и генетически модифицированных клеток.
Вещества, на основе которых может быть создан эффективный и безопасный лекарственный препарат, проходят долгий путь отбора, разработки и тестирования. Из нескольких тысяч перспективных субстанций, отобранных на начальной стадии, многие «сходят с дистанции», и в конце остается только одно вещество, которое и попадает на рынок в виде лекарственного препарата.
Поиск действующего вещества
Заболевания возникают тогда, когда естественные процессы организма изменяются или не функционируют надлежащим образом. При разработке препарата важно на молекулярном уровне разобраться, что происходит не так. Тогда патологический процесс может быть выбран в качестве «мишени» и откорректирован. «Мишенью» может быть выбрана молекула, вырабатываемая организмом в чрезмерном или недостаточном объеме, или молекула, которая имеет патологическую структуру.
В процессе поиска перспективных веществ для создания новых лекарственных препаратов проводится тестирование клеточных культур — в лабораторных условиях и виртуально — для отбора и создания субстанций, которые связываются с молекулами-мишенями и влияют на их функцию. Над тестами работают медики, химики, биологи и специалисты в области информационных технологий.
Доклинические исследования
Перспективное действующее вещество-кандидат проходит полный цикл проверок. Первые тесты проводятся в пробирке и на клеточных культурах (in vitro). Везде, где возможно, компания Johnson & Johnson отказывается от проведения анализов на лабораторных животных и вместо этого работает с клеточными культурами или ещё более мелкими единицами, так называемыми субклеточными структурами. Однако некоторые свойства препарата можно протестировать только на живом организме (in vivo), так что действующие вещества, успешно прошедшие испытания in vitro, тестируются также и на животных.
Специалисты в области фармакокинетики и фармакодинамики оценивают влияние действующего вещества и реакцию организма. Вместе с эффективностью также исследуется, как вещество всасывается, распределяется в организме животного, как происходит распад вещества в организме и как вещество выводится из него. Тщательно продуманные порядок проведения теста и методы анализа позволяют перенести результаты исследования, проведенного на животных, на человека.
В токсикологических испытаниях проверяется безопасность действующего вещества. Исследуется действие фармацевтических субстанций на сердце и почки, чтобы убедиться, что новые субстанции не оказывают токсического воздействия на организм, не влияют на репродуктивную функцию и не вызывают дефекты развития п�лода, не провоцируют развитие онкологии и изменения в геноме.
Только после того, как фармацевтическая субстанция успешно прошла все доклинические тесты, можно приступать к проведению исследования на людях. Здесь необходимо решить, как будет вводиться препарат: перорально или в виде инъекции. Также нужно проверить возможность производства потенциального лекарственного препарата в промышленном масштабе. Только после этого разработка препарата переходит на стадию клинических испытаний.
Для допуска лекарственного препарата на рынок нужно подтвердить эффективность и безопасность препарата. Для этого проводят клинические испытания. Различают четыре фазы клинических исследований, которые лекарственный препарат проходит, как правило, последовательно.

Что такое клиническое исследование?
Клиническое исследование – это тщательно спланированная научная оценка экспериментального лекарственного препарата или метода лечения.
Оценки проводятся врачами и исследователями и помогают ответить на важные медицинские вопросы, такие как:
- Безопасен ли исследуемый препарат?
- Как он ведет себя в организме человека?
- Какое действие он оказывает при определенных заболеваниях и состояниях?
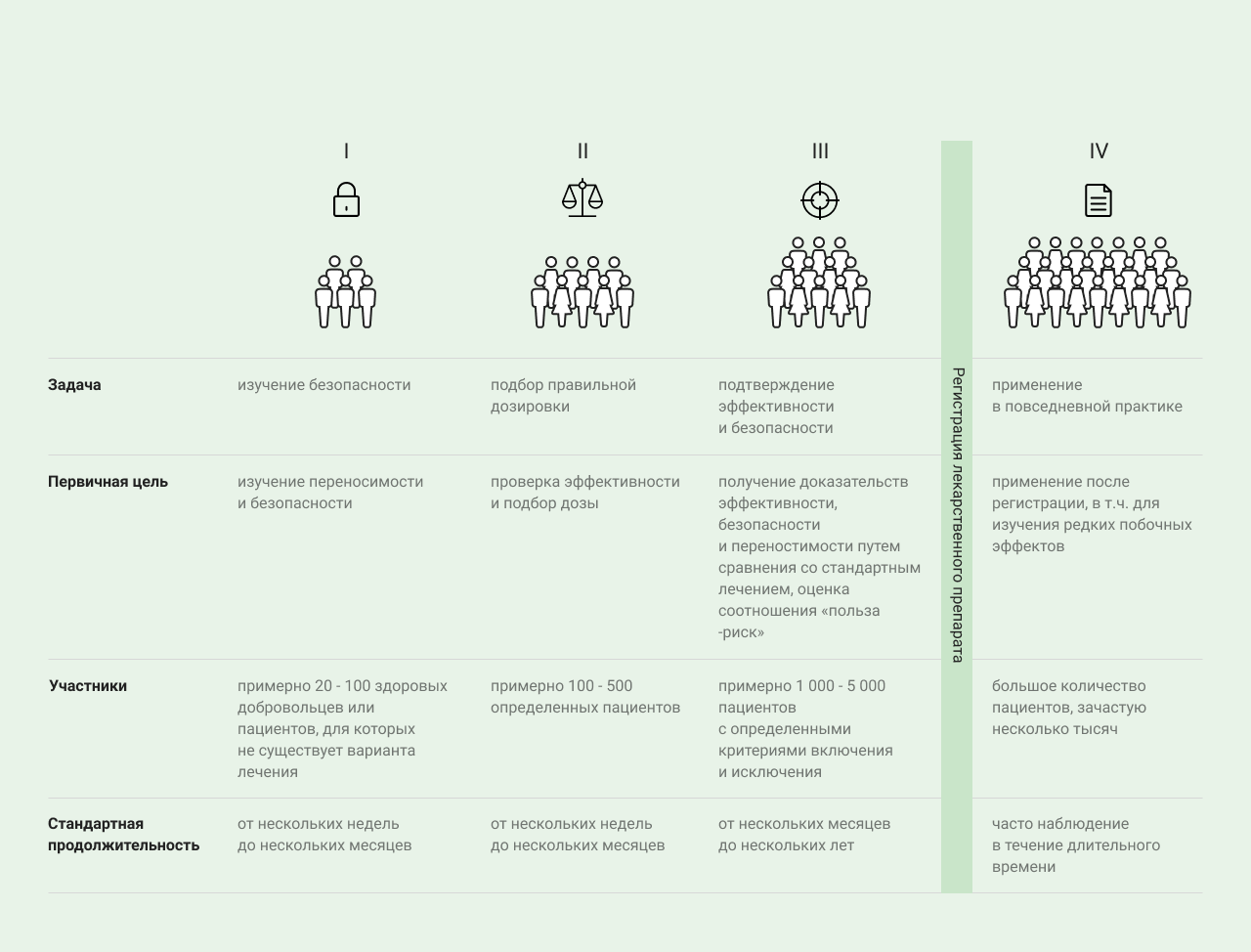
Различают четыре фазы клинического исследования:
Для чего нужны клинические исследования?

После допуска препарата на рынок (то есть получения разрешения на его продажу) могут понадобиться дальнейшие исследования для детального изучения действия препарата.

Наши клинические исследования соответствуют строгим научным, правовым и этическим требованиям. Безопасность и защита людей, которые участвуют в исследовании — наш приоритет. Клинические исследования, планируемые для проведения в России, рассматриваются и одобряются Министерством Здравоохранения Российской Федерации и независимыми этическими комитетами.
Фазы клинического исследования
| В I фазе проводятся первые испытания лекарственного препарата на людях | В I фазе проводятся первые испытания лекарственного препарата на людях для изучения его переносимости, безопасности и фармакокинетики, то есть фармакокинетического поведения действующего вещества в организме. Как правило, в испытаниях прин�имают участие здоровые добровольцы. Осуществляется сбор первых данных о безопасности и максимальной переносимой дозе препарата. Как правило, также изучаются фармакокинетические характеристики фармацевтической субстанции, то есть распределение и выведение из организма, а также влияние поступающих в организм продуктов питания и взаимодействие с другими действующими веществами. После успешной оценки соотношения пользы–риска приступают к клиническим исследованиям II фазы. |
| Во II фазе действие лекарственного препарата изучается на пациентах с конкретным заболеванием | Во II фазе действие лекарственного препарата изучается на пациентах с конкретным заболеванием. В изучении дозировки препарата и эффективности лечения заболевания принимает участие строго определенная группа. |
| В III фазе продолжается изучение эффективности и безопасности исследуемой субстанции и оценивается соотношение пользы - риска | После успешного завершения фазы II начинаются клинические испытания III фазы, в которых продолжается изучение эффективности и безопасности исследуемой субстанции и оценивается соотношение пользы-риска. Участие в исследованиях III фазы больших групп людей (более 1000 участников) позволяет точнее оценить редко встречающиеся побочные эффекты. По результатам исследований III фазы принимается решение о выпуске препарата на рынок. Фаза проходит в форме контролируемых рандомизированных анализов, в рамках которых пациенты распределяются по группам. Для одной группы выбирается способ введения и рекомендованная терапевтическая доза испытуемой субстанции. Сравнение проводится с контрольной группой пациентов, которые получают стандартное при данном заболевании лечение. Пациенты распределяются по группам лечения случайным образом, это называется рандомизация. Клинические испытания, проводимые после допуска лекарственного препарата на рынок, относятся к IV фазе исследований. Продолжать исследовать препарат, который уже продается, необходимо для того, чтобы получить данные о его применении у большого количества людей. В связи с этим исследования IV фазы проводятся по уже зарегистрированным показаниям, дозе и лекарственной форме. Часто задачей исследователей становится выявление редко возникающих побочных эффектов или изучение взаимодействия препарата с другими лекарственными средствами. |

Области исследований
В Johnson & Johnson Innovative Medicine мы определяем будущее медицины, где заболевания останутся в прошлом. Для этого мы ежедневно инвестируем в исследования и разработки по всему миру около 20 миллионов евро.

На сегодняшний день 18 наших разработок внесены в перечень ВОЗ важнейших жизненно необходимых лекарственных препаратов. Мы направляем наши усилия в те области медицины, где пациенты нуждаются в нас больше всего.
Онкология
Рак предстательной железы, множественная миелома, рак молочной железы, анемия при онкологических заболеваниях, рак яичников, болезнь Каслмана, острый миелоидный лейкоз, хронический лимфоцитарный лейкоз, мантийноклеточная лимфома
Иммунология
Болезнь Крона, псориаз, псориатический артрит, ревматоидный артрит
Инфекционные болезни
ВИЧ, туберкулез, лихорадка Эбола, гепатит, респираторно-синцитиальный вирус, грипп
Психиатрия
Шизофрения, синдром дефицита внимания и гиперактивности (СДВГ), эпилепсия, болезнь Альцгеймера, депрессия
Легочная артериальная гипертензия
Наши клинические наблюдения могут стать источником знаний для других исследователей. Поэтому мы стремимся к информационной прозрачности: мы публикуем результаты своих исследований в научных журналах и выступаем на научных конференциях. Мы также регистрируем результаты своих испытаний на следующих платформах:
- Международная база данных http://www.clinicaltrials.gov
- Перечень клинических исследований, проводимых в настоящее время в Европе, представлен в европейском реестре EudraCT https://eudract.ema.europa.eu и на сайте Европейского агентства по лекарственным средствам (ЕМА) http://www.ema.europa.eu/ema/
- Перечень клинических исследований, разрешенных для проведения в России, представлен на сайте https://grls.rosminzdrav.ru/CIPermitionReg.aspx
Клинические исследования после допуска лекарственного препарата на рынок
Что такое неинтервенционные (наблюдательные) исследования и для чего они нужны?
В неинтервенционном (наблюдательном) исследовании изучается применение лекарственного препарата в реальной клинической практике, когда лекарственный препарат уже получил необходимые разрешения. В сравнении с интервенционными клиническими испытаниями, которые проводятся в строгом соответствии с предписаниями и с участием четко определенной группы пациентов, при наблюдательном исследовании врач применяет стандартные методы лечения своих подопечных и документирует процесс лечения: например, фиксирует, какие еще препараты назначает пациенту и следит за его состоянием в процессе лечения. Поэтому эти исследования и называются неинтервенционными — они не предполагают вмешательства в лечение. Их цель — проверить, действительно ли полученные ранее данные о препарате отражают реальную клиническую практику его применения. Даже после регистрации лекарственного препарата важно собирать информацию о его безопасности, эффективности и возможных побочных эффектах.
Какое лечение получает пациент в рамках наблюдательного исследования?
Участие в наблюдательном исследовании напрямую никак не отражается на пациенте: он в любом случае получает лечение, назначенное врачом. Персональные данные, полученные в рамках наблюдения, можно использовать только с согласия пациента. Участвуя в исследовании, человек разрешает документировать и оценивать данные о своем лечении и этим вносит важный вклад в совершенствование терапии и понимание причин развития болезни.
Какими нормативными актами регулируются наблюдательные исследования?
Проведение наблюдательных исследований строго регламентировано. Они проводятся в соответствии с международными стандартами качества: наряду с согласием пациента, полученным после разъяснительной беседы, наблюдательный анализ рассматривается и утверждается независимыми этическими комитетами.
Кто может принять участие в клиническом исследовании?
В каждом клиническом проекте участники отбираются по определенным признакам (критериям).
Характеристики, определяющие, кто может принять участие в клиническом исследовании, называются критериями включения. Те характеристики, которые определяют неприемлемость участия, называются критериями невключения. К таким характеристикам могут относиться пол, возраст, наличие определенного заболевания, его стадия и длительность, особенности предшествующего лечения, сопутствующие заболевания и пр.
Критерии помогают правильно отобрать участников и обеспечить их безопасность. Критерии необходимы также для того, чтобы исследователи смогли ответить на вопросы, которые планируется изучить.
Можно ли продолжать наблюдаться у своего врача во время исследования?
Да. В большинстве клинических испытаний предполагается краткосрочное участие пациента, связанное с определенной болезнью или состоянием. Не всегда в рамках исследования предоставляется расширенная или вся полная первичная медицинская помощь.
Взаимодействие лечащего врача и исследовательской команды необходимо также для того, чтобы другие лекарства или методы лечения не противоречили протоколу клинического испытания.
Что такое «информированное согласие»?
Если Вы решите, что хотите принять участие в исследовательском проекте, Вам будет предоставлен документ, который называется «Форма информированного согласия». Этот документ содержит важную информацию о клиническом исследовании и подтверждает Ваше согласие участвовать в нем. Цель информированного согласия состоит в том, чтобы убедиться, что Вы:
- понимаете, что включает в себя Ваше участие в клиническом испытании, в том числе потенциальные побочные эффекты и другие риски, связанные с исследуемым лекарством или процедурами;
- понимаете свои обязанности как участника исследования;
- получили ответы на все Ваши вопросы об испытании;
- действительно хотите участвовать в исследовании;
- знаете о том, что можете отказаться от участия и покинуть проект в любой момент.
Вы можете взять этот документ домой, чтобы еще раз внимательно прочитать его и посоветоваться с родными, друзьями и Вашим лечащим врачом перед тем, как принять решение.
Даже после подписания формы согласия Вы можете отказаться от участия в проекте в любое время.
Что произойдет, если Вы решите присоединиться к клиническому исследованию?
После того, как участник подпишет форму информированного согласия, его попросят пройти скрининговый визит. На этом визите участник проходит тесты и обследования (как описано в форме информированного согласия), чтобы убедиться, что он действительно подходит для участия в данном проекте. Как только это подтверждено, пациент может быть включен в состав группы.
Во время исследования пациент должен регулярно посещать врача-исследователя и проходить необходимые процедуры (как описано в форме информированного согласия). Во время испытания Ваше состояние будет тщательно контролироваться исследовательской командой, в которую входят врачи, медсестры и другие медицинские работники. Они проверяют здоровье участника проекта, инструктируют и наблюдают за ним от начала до конца. Некоторые клинические исследования связаны с большим количеством обследований и визитов к врачу, чем это требуется для обычного лечения заболевания. Залог успешного участия в клиническом исследовании – в строгом соблюдении требований протокола и частом контакте с исследовательской командой.
Может ли участник покинуть клиническое исследование после его начала?
Присоединившись к клиническому испытанию, доброволец имеет право прекратить свое участие в любое время и по любой причине. Если пациент хочет отказаться от участия, он должен сообщить об этом исследовательской команде, чтобы было обеспечено безопасное прекращение лечения в проекте и организовано соответствующее медицинское наблюдение.
Что мне следует обсудить с врачом?
Перед тем как участвовать в клиническом исследова�нии, Вам нужно обсудить с врачом и обдумать следующие вопросы:
- Какова конкретная цель клинического испытания?
- Как будет проходить исследование?
- Кто будет оплачивать проект?
- Какие затраты для меня влечет за собой участие в исследовании?
- Предусмотрено ли возмещение затрат?
- Предусмотрено ли страхование участников?
- Сколько будет продолжаться исследование?
- Ка�ковы мои обязанности как участника проекта?
- Необходимо ли длительное медицинское наблюдение после испытания?
- Каковы польза и риски участия в проекте по сравнению с прежними методами лечения?
- Есть ли уже опыт применения новых методов лечения?
- Каковы возможные побочные эффекты?
- Кто отвечает за поддержку участников исследования?
- К кому я могу обратиться в экстренном случае или при возникновении вопросов?
- Какие данные будут собираться, обрабатываться и храниться?
- С какими ограничениями придется столкнуться в начале или во время клинического испытания (например, можно ли планировать беременность, можно ли пить спиртное)?
- Что будет, если проект завершится досрочно?
- Как будет проходить лечение, если оно будет необходимо, после исследования?